Nhôm (Al) là kim loại phổ biến và được sử dụng nhiều nhất hiện nay, nhôm là kim loại dẫn điện và dẫn nhiệt tốt nhất, có thể tham gia phản ứng với nhiều loại dung dịch khác nhau. Tuy nhiên theo các bạn thì kim loại Al không phản ứng với dung dịch nào, vì sao? Hãy cùng thuvienhoidap.net tìm đáp án cho câu hỏi thuộc chủ đề hóa học này nha.
Bạn đang xem bài: Kim loại Al không phản ứng với dung dịch nào?
Video hướng dẫn kim loại nhôm tác dụng với dung dịch
Kim loại Al không phản ứng với dung dịch ?
Al không phản ứng với dung dịch axit HNO3, H2SO4 đặc nguội vì:
- Trước khi phản ứng với HNO3, H2SO4 đặc nguội vì nó tạo thành một lớp oxit của Al2O3 và lớp oxit này không cho phép phản ứng của HNO3, H2SO4 với Al xảy ra.
- Bởi vì lý do này Al được sử dụng để lưu trữ HNO3, H2SO4 đặc nguội
- Dung dịch HNO3, H2SO4 đặc nguội cũng không phản ứng với Al hoặc bất kỳ kim loại nào khác (ngoại trừ mangan và magie) vì HNO3, H2SO4 đặc nguội là chất oxi hóa mạnh.
Ngoài ra, nhôm cũng không phản ứng với dung dịch nước ở bất kỳ điều kiện nhiệt độ nào.
- Kim loại nhôm nhanh chóng phát triển một lớp nhôm oxit mỏng vài mm ngăn kim loại phản ứng với nước. Khi lớp này bị ăn mòn sẽ xảy ra phản ứng, giải phóng khí hydro rất dễ cháy.
Kim loại Al là gì?
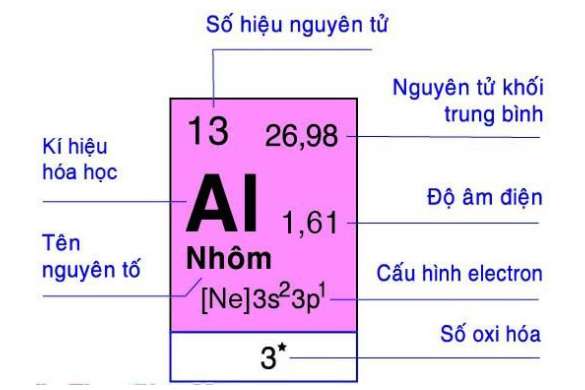
- Nhôm là kim loại màu trắng bạc, là nguyên tố thứ 13 trong bảng tuần hoàn. Al là nó là kim loại phổ biến nhất trên trái đất, chiếm hơn 8% khối lượng lõi của Trái đất. Nó cũng là nguyên tố hóa học phổ biến thứ ba trên hành tinh của chúng ta sau oxy và silicon.
- Dạng nhôm phổ biến nhất được tìm thấy trong tự nhiên là nhôm sunfat hay còn gọi là phèn chua. Đây là những khoáng chất kết hợp hai axit sunfuric: một dựa trên kim loại kiềm (liti, natri, kali rubidi hoặc xêzi) và một dựa trên kim loại từ nhóm thứ ba của bảng tuần hoàn, chủ yếu là nhôm.
Tính chất vật lý của nhôm – Al
- Al là kim loại màu trắng bạc, có độ dẻo cao nên dễ uốn và kéo thành sợi nhỏ.
- Nhôm là kim loại có dẫn điện cao, dẫn nhiệt tốt.
- Bột nhôm có thể bốc cháy dữ dội khi nung nóng trong không khí và phát ra ngọn lửa trắng chói.
- Điểm nóng chảy là 660 ° C
- Điểm sôi là 2327 ° C.
- Rất khó tan trong nước nóng và nước lạnh.
- Tỷ trọng: 2,7 g/cm³
- Khối lượng nguyên tử 26,98154
- Cấu hình phân tử là tinh thể lập phương tâm diện, hóa trị là +3
- Là kim loại hoạt động mạnh trong dãy điện hóa kim loại.
- Độ cứng của nhôm chỉ đứng sau kim cương, có nhiệt độ nóng chảy cao và chịu được axit và kiềm.
Tính chất hóa học của Al
- Nhôm là kim loại có tính khử mạnh, nó chỉ đứng sau 2 nhóm kim loại kiềm và kiềm thổ, nên có thể phản ứng với axit, bazơ, với nhóm halogen, tác dụng với dung dịch muối, oxit kim loại và tác dụng với nước.
Al tác dụng với axit
- Vì là kim loại có tính khử mạnh nên nhôm có thể tác dụng được với hầu hết các loại axit mạnh trừ axit H2SO4, HNO3 đặc nguội.
Nhôm tác dụng với H2SO4, HCl, HNO3 loãng
Phương trình phản ứng Al tác dụng với HCl, H2SO4, HNO3 loãng, sản phẩm tạo thành là muối và giải phóng khí H2, riêng với HNO3 loãng thì sản phẩm tạo thành là khí NO, muối và nước.
- 2Al + 6HCl ( loãng ) → 2AlCl3 + 3H2
- 2Al + 3H2SO4 ( loãng) → Al2(SO4)3 + 3H2
- Al + 4HNO3 (loãng) → Al(NO3)3 + NO + 2H2O
Phương trình Al tác dụng với H2SO4 đặc nóng
Vì là kim loại hoạt động mạnh nên Al có thể tác dụng với axit H2SO4 đặc nóng.
- 2Al + 6H2SO4 (đặc nóng) → Al2(SO4)3 + 3SO2 + 6H2O
Phương trình phản ứng Al tác dụng với HNO3 đặc
- Al + 6HNO3 (đặc) → Al(NO3)3 +3NO2 + 3H2O
Phương trình phản ứng Al tác dụng với HNO3 đặc nóng
- 8Al + 30HNO3 (đặc nóng)→ 8Al(NO3)3 + 3N2O + 15H2O
Ngoài ra phản ứng giữa Al và HNO3 có thể xảy ra nhưng rất hiếm gặp, cần chất xúc tác phù hợp là
- 8Al +30HNO3 → 8Al(NO3)3 + 3NH3NO3 + 9H2O
Al tác dụng với Axit axetic
Nhôm còn phản ứng với axit hữu cơ như Axit axetic theo phương trình phản ứng sau
- CH3COOH + 2Al → 2Al(CH3COO)3 + 3 H2
b – Nhôm phản ứng với nhóm halogen
Nhôm có thể khử dễ dàng các phi kim thuộc nhóm halogen thành ion âm, sản phẩm tạo thành là muối muối nhôm.
Tụ nhôm cũng chứa halogen chất gây phản ứng mạnh đặc biệt khi mắc nối tiếp tụ điện phản ứng này xảy ra mãnh liệt hơn nên người ta đã hạ lượng halogen xuống tránh gây cháy nổ !
Ví dụ phản ứng giữa Al với nhóm halogen
- 2Al + 3Cl2 → 2AlCl3
- 2Al + 3Br2 → 2AlBr3
- 2Al + 3F2 → 2AlF3
- 2Al + 3I2 → 2AlI3
c – Nhôm phản ứng với dung dịch bazơ
Nhôm có thể tan trong dung dịch kiềm và giải phóng khí hiđro
Phương trình phản ứng nhôm tác dụng với NaOH
- 2Al + 2NaOH + 2H2O → 2NaAlO2 + 3H2
Hoặc có thể viết bằng cách sau:
- 2Al + 2NaOH + 6H2O → 2NaAl(OH)4 + 3H2
Khi cho nhôm tác dụng trực tiếp với dung dịch NaOH thì phản ứng sẽ không xảy ra nhưng sản phẩm tạo thành khi cho Al tác dụng với NaOH là Al2O3 là oxit lưỡng tính nên lớp màng mỏng Al2O3 bên trên bề mặt nhôm tác dụng với dung dịch kiềm tạo ra muối tan.
Khi không còn màng oxit bảo vệ, nhôm sẽ tác dụng với nước để tạo ra hợp chất Al(OH)3 và giải phóng khí H2. Vì Al(OH)3 là hidroxit lưỡng tính nên sẽ tác dụng tiếp tục với dung dịch kiềm:
- Al(OH)3 + NaOH → NaAlO2 + 2H2O
Nhôm cũng tác dụng được với dung dịch KOH, bằng phương trình phản ứng sau:
- Al + 2KOH + 2H2O → 2KAlO2 + 3H2
Nhôm tác dụng với dung dịch NH3
Vì NH3 cũng là một bazơ nên Al tác dụng được với khí amoniac
Al + 3NH3 + 3H2O → Al(OH)3 + 3NH4
d – Nhôm tác dụng với oxi
Nếu đốt bột nhôm trong không khí sẽ xảy ra hiện tượng là ngọn lửa sáng chói, tỏa nhiều nhiệt
4Al + 3O2 → 2Al2O3
Nhôm bền trong không khí ở nhiệt độ thường do có màng oxit Al2O3 rất mỏng và bền bảo vệ.
Tương tự, nhôm tác dụng với lưu huỳnh với điều kiện nhiệt độ cao.
2Al + 3S → Al2S3
e – Phản ứng với oxit kim loại
Khi ở nhiệt độ cao, Al khử được nhiều ion kim loại trong oxit.
Phản ứng giữa Al với Fe2O3
- 2Al + Fe2O3 → Al2O3 + 2Fe
Phản ứng giữa Al với Fe3O4
- 8Al + 2Fe3O4 → 4Al2O3 + 9Fe
Ngoài ra, Al tác dụng với các oxit kim loại có tính khử thấp hơn như CuO, ZnO…
- 2Al + 3CuO → Al2O3 + 3Cu
- 2Al + 3ZnO → Al2O3 + 3Zn
g – Tác dụng với nước
Nếu phá bỏ lớp vỏ trên bề mặt nhôm thì nhôm sẽ tác dụng được với nước ở nhiệt độ thường.
Phương trình phản ứng: 2Al + 6H2O → 2Al(OH)3 + 3H2
Lưu ý: là ở trạng thái bình thường nhôm không tác dụng được với nước, dù ở nhiệt độ cao, nguyên nhân là trên bề mặt nhôm được phủ kín một lớp oxit nhôm Al2O3 rất mỏng, bền và mịn, không cho nước thấm vào và khí thấm qua được.
h – Nhôm tác dụng với dung dịch muối
Nhôm có thể tác dụng với nhiều dung dịch muối có gốc kim loại có tính khử thấp hơn nhôm như muối sunfat để tạo thành muối mới.
Ví dụ phản ứng giữa nhôm và muối
- 2Al + 3CuSO4 → Al2(SO4)3 + 3Cu
- 2Al + 3CuCl2 → 2AlCl3 + 3Cu
- 2Al + 3FeSO4 → Al2(SO4)3 + 3Fe
- 3FeCl3 + Al → 3FeCl2 + AlCl3
- 2Al + 3FeCl2 → 2AlCl3 + 3Fe
Phương pháp điều chế nhôm
Trong công nghiệp, nhôm được sản xuất bằng phương pháp điện phân nhôm oxit nóng chảy.
Nguyên liệu để sản xuất nhôm là quặng boxit Al2O3.2H2O.
- Bước 1: Hòa tan bôxit trong dung dịch NaOH : Al2O3 + 2NaOH + 3H2O = 2NaAl(OH)4
- Bước 2: Lọc các tạp chất còn sót lại như oxit sắt (FeO), natri aluminosilicat…
- Bước 3: quá trình axit hóa: cho CO2 dư vào dịch lọc:
- NaAl(OH)4 + CO2 → Al(OH)3↓ + NaHCO3
- Bước 4: Lọc và đốt Al(OH)3: 2Al(OH)3 → Al2O3 + 3H2O
- Bước 5: Điện phân oxit nhôm Al2O3 sẽ thu được nhôm nguyên chất : 2Al2O3 → 4Al + 2O2
Lưu ý: AlCl3 không bị điện phân nóng chảy để tạo ra Al, vì: AlCl3 là hợp chất cộng hóa trị , và độ dẫn điện của nó ở trạng thái nóng chảy rất kém.
Ứng dụng của nhôm
Nhôm là kim loại được sử dụng rộng rãi và phổ biến nhất hiện nay, nó được ứng dụng trong nhiều lĩnh vực khác nhau gồm:
Nhôm dùng làm vật liệu công nghiệp
Những hợp kim nhôm được sử dụng rộng rãi trong các ngành sản xuất như máy bay, ô tô, xe lửa và tàu thủy. Ngoài ra, tên lửa vũ trụ, tàu con thoi và vệ tinh cũng sử dụng một lượng lớn nhôm và hợp kim nhôm của nó.
Ví dụ, một máy bay siêu thanh được cấu tạo từ khoảng 70% nhôm và các hợp kim nhôm của nó. Nhôm cũng được sử dụng với số lượng lớn trong đóng tàu, lượng nhôm sử dụng trên một con tàu chở khách lớn thường lên tới vài nghìn tấn.
Nhôm là chất dẫn điện và dẫn nhiệt tốt
Độ dẫn điện của nhôm chỉ đứng sau bạc, đồng và vàng, tuy độ dẫn điện chỉ bằng 2/3 đồng nhưng khối lượng riêng chỉ bằng 1/3 đồng nên chất lượng của dây nhôm chỉ bằng 1/2 so với dây đồng đối cùng một lượng điện.
Lớp màng oxit trên bề mặt nhôm không chỉ có khả năng chống ăn mòn mà còn có độ cách nhiệt nhất định nên nhôm được ứng dụng rộng rãi trong công nghiệp sản xuất điện, công nghiệp dây cáp, truyền thanh.
Nhôm là chất dẫn nhiệt tốt, khả năng dẫn nhiệt lớn gấp 3 lần sắt, nhôm có thể dùng để sản xuất các bộ trao đổi nhiệt, vật liệu tản nhiệt và dụng cụ nấu ăn trong công nghiệp.
Ứng dụng trong ngành công nghiệp thực phẩm
Nhôm có độ dẻo tốt (độ dẻo của nó chỉ đứng sau vàng và bạc) và có thể được làm thành lá nhôm mỏng hơn 0,01 mm ở 100 ℃ đến 150 ℃. Những lá nhôm này được sử dụng rộng rãi để đóng gói thuốc lá, kẹo, thực phẩm và cũng có thể được làm thành dây nhôm, dải nhôm và các sản phẩm nhôm cuộn khác nhau .
Nhôm dùng để sản xuất pin
Pin nhôm-air là một loại pin mới sử dụng nhôm và không khí làm vật liệu chế tạo pin. Đây là một nguồn cung cấp điện không gây ô nhiễm, bền lâu, ổn định và đáng tin cậy và nó là một loại pin rất thân thiện với môi trường.
Cấu trúc của pin và các nguyên liệu thô được sử dụng có thể thay đổi tùy theo các yêu cầu và môi trường thực tế khác nhau và nó có khả năng thích ứng cao. Nó có thể được sử dụng trên đất liền và dưới biển sâu. Nó có thể được sử dụng như một pin điện và có thể được sử dụng làm pin tín hiệu cụ thể có tuổi thọ cao và năng lượng cao.
Những công dụng khác của nhôm
- Bột nhôm có màu trắng bạc ánh kim thường được dùng làm sơn, thường được gọi là bột bạc và sơn bạc để bảo vệ sản phẩm sắt không bị ăn mòn và bóng đẹp.
- Do có lớp màng bảo vệ oxit dày đặc trên bề mặt nhôm nên nhôm không dễ bị ăn mòn nên thường được sử dụng để chế tạo lò phản ứng hóa học , thiết bị y tế, thiết bị điện lạnh, thiết bị lọc dầu, đường ống dẫn dầu và khí đốt tự nhiên.
- Nhôm có đặc tính hút âm, tiêu âm tốt nên nhôm còn được sử dụng làm trần của các phòng phát sóng và các công trình hiện đại có quy mô lớn.
- Nhôm còn có tính năng phản xạ ánh sáng tốt, phản xạ tia cực tím mạnh hơn bạc, nhôm càng tinh khiết thì khả năng phản xạ càng tốt, vì vậy nó thường được dùng để sản xuất các loại gương chất lượng cao như gương năng lượng mặt trời.
- Nhôm cũng được sử dụng như một chất khử oxy trong quá trình luyện thép. Bột nhôm, than chì, titan đioxit được trộn đều theo một tỷ lệ nhất định, sau đó phủ lên kim loại và nung ở nhiệt độ cao để tạo ra kim loại chịu nhiệt độ cao.
Mộ số câu hỏi :
Kim loại al tác dụng được với dung dịch
- Kim loại nhôm tác dụng được với dung dịch Cu(NO3)2
Kim loại al không phản ứng được với dung dịch
- Kim loại nhôm không phản ứng với dung dịch H2SO4 (đặc, nguội).
Nhôm và sắt không phản ứng với ?
- Nhôm (Al) và sắt (Fe) bị thụ động hóa trong axit HNO3 và H2SO4 đặc nguội.
Ở nhiệt độ thường kim loại nhôm tác dụng được với dung dịch ?
- Ở nhiệt độ thường, kim loại Al tác dụng được với dung dịch : Cu(NO3)2
Al có tác dụng với nước không ?
- Al không phản ứng với nước vì được lớp oxit mỏng, bền và đặc khít bảo vệ. Nếu phá bỏ lớp oxit bao phủ bề mặt, Al phản ứng trực tiếp với nước. 2Al + 6H2O → 2Al(OH)3 + 3H2
- Lưu ý: Al(OH)3 là chất kết tủa dạng keo màu trắng khi sinh ra sẽ bao kín bề mặt của Al kim loại ngăn cách không cho Al tiếp xúc với nước để phản ứng tiếp nữa. Phản ứng này chỉ có ý nghĩa về mặt lý thuyết.
Từ khóa tìm kiếm : kim loại al không tác dụng được với dung dịch,ở nhiệt độ thường al tác dụng với dung dịch,ở nhiệt độ thường kim loại al tác dụng được với dung dịch,ở nhiệt độ thường kim loại nhôm tác dụng được với dung dịch,al không tác dụng với chất nào sau đây,kim loại không phản ứng với dung dịch,kim loại al ko phản ứng với dung dịch,al không tác dụng với dung dịch nào,kim loại al tác dụng với dung dịch,nhôm sắt không tác dụng được với chất nào,al có tác dụng với hno3 đặc nguội không,ở nhiệt độ thường kim loại al tác dụng được với dung dịch nào sau đây
Đánh Giá
9.7
100
Hướng dẫn oke ạ !
User Rating: Be the first one !
Trích nguồn: Cao đẳng Tài nguyên và Môi trường miền Trung
Danh mục: Biểu mẫu
